QS Informa Voltar FDA NEWS!
Última atualização: 07 de março de 2019 4:06 pm
FDA NEWS!
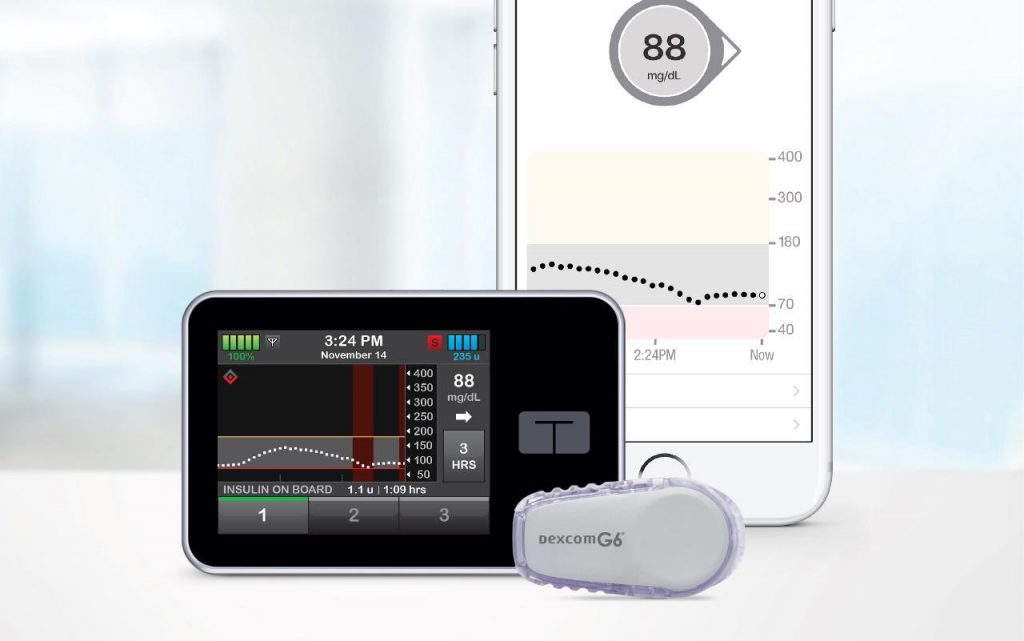
Agência norte americana autorizou a comercialização da bomba de insulina "Tandem Diabetes Care t: Slim X2", da empresa Tandem Diabetes Care Inc.
O US-FDA autorizou a comercialização da bomba de insulina “Tandem Diabetes Care t: Slim X2” com tecnologia interoperável para administrar insulina sob a pele para crianças e adultos com diabetes. Este novo tipo de bomba de insulina, conhecida como bomba de infusão ACE (alternate controller enabled), é a primeira bomba interoperável, o que significa que pode ser usada com diferentes componentes que compõem os sistemas de terapia de diabetes, permitindo aos pacientes adequar seu gerenciamento de diabetes para suas preferências de dispositivo individuais. Os sistemas de terapia de diabetes podem ser compostos por uma bomba de insulina ACE e outros dispositivos médicos compatíveis, incluindo sistemas automáticos de dosagem de insulina (AID), monitores contínuos de glicose (CGMs), medidores de glicose no sangue ou outros dispositivos eletrônicos usados para o controle da diabetes. Junto com a autorização, o FDA está estabelecendo critérios que descrevem os requisitos para garantir a precisão, confiabilidade, segurança cibernética e relevância clínica das bombas de infusão ACE, bem como descrever os tipo de estudos e dados necessários para demonstrar o desempenho aceitável da bomba. O FDA concedeu a autorização de comercialização à Tandem Diabetes Care Inc.
Fonte: FDA